Протеины различного рода играют чрезвычайно важную роль в организме человека. Структурные белки соединительной ткани содержат коллаген, протеины кожи - кератин, мышечные - включают актин и миозин, а клеточные соединены с тубулином.
Другие белки представляют собой ферменты, которые ускоряют химические реакции внутри клеток, гормоны и антитела - протеины, участвующие в защите организма от вредных воздействий и заболеваний. Белки крови, такие как гемоглобин, альбумин и ряд других, отвечают за то, что кровь свертывается, только когда это необходимо, например при травме.
Аминокислоты - структурные единицы
Как и все органические вещества, белковые молекулы построены из атомов углерода, водорода и кислорода. Кроме того, протеины содержат азот и во многих случаях серу.
Основной структурной единицей белковой молекулы является аминокислота. Известно около 20 типов аминокислот, которые могут соединяться между собой, образуя огромное количество всевозможных комбинаций. Некоторые аминокислоты могут быть синтезированы в организме, другие поступают только из внешней среды. Для поддержания здоровья человек должен употреблять минимум 30 г белка ежедневно.
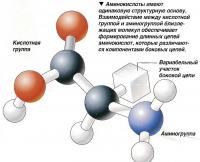
Основу молекулы аминокислоты составляет цепь углеродных атомов. На концах молекулы находятся две разные химические группы: с одной стороны - аминогруппа, с другой - остаток карбоновой кислоты. Аминогруппа одной аминокислоты может вступать во взаимодействие с кислотной группой прилежащей аминокислоты с выделением молекулы воды - этот процесс лежит в основе формирования длинных цепей аминокислот.
Структура аминокислоты определяет ее растворимость в воде, а также амфотерные свойства - способность выступать в роли кислоты и основания одновременно. Это позволяет белковой молекуле существовать как в кислой,так и в щелочной среде. Аминокислоты обладают также свойствами буфера (регулятора уровня pH), что имеет огромное значение для гомеостаза - поддержания постоянства внутренней среды организма.
Матрицей (шаблоном) для образования белковой молекулы является последовательность ДНК. В клетке синтез цепей аминокислот происходит на рибосомах (клеточный элемент) с помощью рибонуклеиновой кислоты (РНК).
Первичная структура
Последовательность аминокислот, собранная на рибосоме, определяет первичную структуру белка. Порядок сборки аминокислот, в свою очередь, определяется последовательностью ДНК. Эта первичная структура представляет каркас белковой молекулы.
Денатурация белка
При нормальных условиях протеины относительно стабильны. Их активность определяется трехмерной структурой и связями, удерживающими молекулу в целости. Однако эти межатомные связи чувствительны к воздействию таких факторов, как повышенная кислотность и температура.
Процесс потери белком его трехмерной структуры называется денатурацией. В некоторых случаях этот процесс может быть обратимым, и при возвращении нормальных условий белки приобретают свою обычную форму. Если же изменение pH и температуры достигает экстремальных значений, протеины денатурируют необратимо.
Уровни организации молекулы белка
Последовательность аминокислот в молекуле белка определяет его конечную трехмерную структуру, в результате чего протеин приобретает свои уникальные свойства.
Вторичная структура
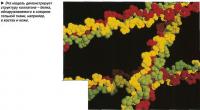
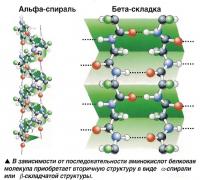
После того как длинная полипеп-тидная цепочка (последовательность аминокислот) сформирована, она начинает организовываться в сложную трехмерную структуру или модель, лишь изредка оставаясь в виде просто цепи аминокислот. Процесс формирования вторичной структуры происходит за счет образования водородных связей, которые, хотя и являются довольно слабыми, достаточно сильны для удержания особой формы протеина. Атомы водорода взаимодействуют с определенными атомами внутри сформированной цепи аминокислот с образованием двух различных по форме моделей белковой молекулы.
Наиболее частой разновидностью вторичной структуры является а-спираль (альфа-спираль), закрученная вправо. Эта структура формируется вследствие образования водородных связей между каждой четвертой аминокислотой. Другая разновидность - /3-складки (бета-складки) -плоская структура, в которой водородные связи возникают между двумя параллельными полипептидными цепями. В некоторых молекулах протеина может наблюдаться чередование обеих разновидностей вторичной структуры на различных участках цепи.
Третичная и четвертичная структура
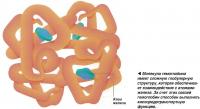
Протеин с очень длинной поли-пептидной цепью может дополнительно сворачиваться в третичную структуру, которая накладывается на вторичную. Это происходит, когда спирали или складки взаимодействуют между собой с образованием шарообразной или сферической структуры. Удерживается она благодаря силам притяжения, возникающим между близко расположенными химическими группами, особенно содержащими атомы серы.
Наконец, протеин может приобретать четвертичную структуру, при которой две или более полипептидных цепей, уже имеющих третичную структуру, взаимодействуют между собой, образуя еще более сложные молекулы. Кроме того, к итоговой структуре могут присоединяться и небелковые группы, например атом железа, как в молекуле гемоглобина. Она имеет четвертичную структуру, сформированную из четырех глобулярных (сферических) полипентидных цепей, каждая из которых включает железосодержащую небелковую часть - гем.
Конфигурация молекулы с третичной и четвертичной структурой специфична для каждого протеина и определяется его первичной структурой, то есть последовательностью аминокислот.
Фибриллярные и глобулярные белки
Протеины подразделяются на две группы по типу их конечной фор-' мы. Фибриллярные или структурные белки напоминают переплетенную нить. Они стабильны и обеспечивают прочность ! и поддержку тканей организма. Большинство фибриллярных
белков имеют вторичную структуру, хотя некоторые из них могут иметь и четвертичную. Коллаген -структурный протеин, обнаруживаемый во всех типах соединительной ткани, представляет собой спираль из трех полипептидных цепей. Другие фибриллярные белки - кератин, эластин и актин.
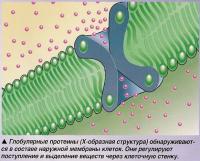
Глобулярные или функциональные протеины химически более активны и участвуют во многих химических реакциях в организме. Они растворимы в воде, имеют сферическую форму и как минимум третичную структуру. Типичным примером глобулярных белков являются ферменты.
Тело человека. Снаружи и внутри. №35 2009