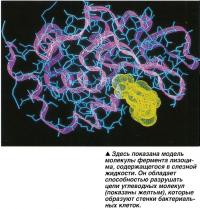
Жизнь каждой клетки организма человека зависит от продукции энергии. Однако химические реакции, в ходе которых высвобождается энергия, обычно проходят при температуре более 90°С. Протекание таких реакций в организме человека при нормальной температуре тела возможно именно благодаря ферментам.
Подавляющее большинство энзимов представляют собой сложные белки, то есть последовательности аминокислот, которые, в свою очередь, состоят из атомов углерода, водорода, кислорода и азота, а во многих случаях еще и серы. Как и все белки, ферменты синтезируются клеткой на матрице ДНК. Некоторые из них, однако, образованы РНК (рибонуклеиновой кислотой, которая вместе с ДНК составляет часть генетического кода) и носят название рибозимов.
Функции ферментов
Ферменты находят широкое применение в производстве многих продуктов, например теста на беременность »
Сахараза, к примеру, относится к катаболическим ферментам - она ускоряет распад сахарозы (обычного сахара) на легко усвояемые глюкозу и фруктозу. Энзим карбоангидраза - анаболический. Он участвует в реакции соединения воды с оксидом углерода (СО2) (промежуточным продуктом процесса синтеза энергии в клетке) с образованием угольной кислоты, которая переносится кровью в легкие и выделяется из организма в виде углекислого газа. Фермент под названием «пермеаза» (почти всегда название энзимов заканчивается на -аза) облегчает транспорт глюкозы через клеточную стенку внутрь клетки, где она может быть использована для образования энергии.
Модель «ключ-замок»
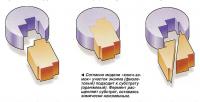
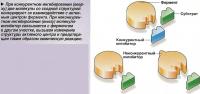
Каждый фермент в организме человека выполняет определенную функцию. Существует множество теорий, объясняющих, каким образом каждый фермент выполняет только одну задачу и никакую другую. Первая из них известна как модель «ключ-замок». Она основана на принципе, что на поверхности молекулы фермента имеется так называемый «активный центр»; с ним соединяется молекула химического вещества - «субстрат», который подходит к нему, как ключ к замку, затем контакт удерживается за счет электрического притяжения.
По окончании реакции субстрат превращается в другое химическое вещество - «продукт», который обладает другими электрическими свойствами, поэтому электрическое взаимодействие исчезает и молекула продукта отделяется от фермента. Весь процесс повторяется с новыми молекулами субстрата бесконечное число раз.
К сожалению, модель «ключ-замок» не объясняет некоторые моменты. Во-первых, на активность ферментов оказывает влияние изменение температуры и pH-среды, что было бы невозможно, если бы взаимодействие «фермент-субстрат» происходило лишь на физическом уровне. Кроме того, другие молекулы, отличные от субстрата, также могут взаимодействовать с активным центром энзима.
Другая теория, известная как теория индуцированного соответствия, объясняет эти противоречия. Согласно данной теории активный центр молекулы фермента имеет гибкую конфигурацию и модифицируется, приспосабливаясь к субстрату, подобно перчатке, принимающей форму руки.
Ферменты и энергия
Ферменты уменьшают энергетические потребности химических реакций. Имея белковую структуру, они подвержены влиянию окружающей среды.
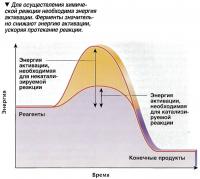
Для осуществления любой химической реакции необходима энергия. Чтобы реакция произошла, одни межатомные связи должны разрушиться, а другие - сформироваться. Энергия, необходимая для разрушения этих связей, называется энергией активации. Задачей ферментов является снижение количества этой энергии, что обеспечивает протекание реакций при более низкой температуре. Сами энзимы при этом не изменяют свой химический состав и структуру.
Что влияет на активность ферментов
Основными факторами, оказывающими влияние на ферментативную активность, являются температура, pH-среды и присутствие других химических веществ, которые могут занять активный центр энзима либо модифицировать его форму.
В зависимости от механизма действия эти вещества называют конкурентными или неконкурентными ингибиторами.
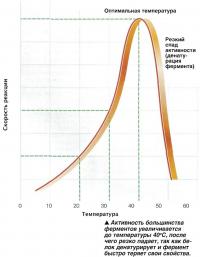
Для каждого фермента в организме человека существует оптимальный температурный режим, в условиях которого он выполняет свои функции максимально эффективно. За пределами этого диапазона связи удерживающие атомы в сложной белковой молекуле, из которых состоит большинство ферментов, начинают разрушаться. В результате происходит изменение структуры активного центра энзима, что приводит к тому, что субстрат не может к нему присоединиться. Именно по этой причине наблюдается нарушение работы всех систем организма при слишком высокой (гипертермия) или слишком низкой (гипотермия) температуре тела.
Подобно температурному режиму, ферменты имеют также и оптимальный диапазон pH, в пределах которого они обладают наибольшей активностью. Вне этого диапазона действие ферментов подавляется, а при экстремальных значениях полностью прекращается (pH -это показатель, отражающий концентрацию ионов водорода в растворе; он показывает ~ кислотной или щелочной является среда. Дистиллированная вода, например, имеет pH, равное 7, хлорная известь - около 12, а апельсиновый сок - около 2).
Оптимальный диапазон у разных ферментов различен, потому что среды организма, в которых они действуют, имеют различное значение pH. Для поддержания pH на постоянном уровне существуют так называемые буферные системы, которые сглаживают небольшие колебания. Желудочные ферменты, например пепсин и химотрипсин, лучше всего работают в кислой среде (рН<7), что обусловлено тем, что они выполняют свою функцию в кислой среде желудка.
Конкурентное и неконкурентное ингибирование
Ферментная активность может быть ингибирована (подавлена) присутствием других веществ.
При конкурентном ингибировании активный центр энзима занимает молекула, идентичная субстрату (конкурирующая). Этот механизм лежит в основе действия многих отравляющих веществ, в том числе цианидов, которые блокируют работу ферментов и вызывают смерть. Другие яды, например свинец и ртуть, оказывают такой же эффект, но благодаря неконкурентному ингибированию. Они не могут непосредственно взаимодействовать с активным центром, но присоединяются к молекуле энзима и деформируют ее.
Тело человека. Снаружи и внутри. №39 2009